Stavba - odhlučnění, odvlhčení, reakce na oheň
Sanace zdiva X. – Způsoby snížení vlhkosti zdiva: Elektroosmóza
17. 1. 2023
| Elektroosmotické metody jsou způsoby sanace vytvářející potenciál stejnosměrného elektrického proudu ve zdivu, který potlačuje proces kapilárního vzlínání vody. Jde o metodě přímé sanace vlhkého zdiva určenou pro všechny druhy materiálů a konstrukcí s pórovitou strukturou, ve kterých dochází k pohybu vody působením kapilárních sil. |
První pokus dokládající existenci elektrokinetických jevů byl uskutečněn roku 1807 profesorem F. F. Reussem na univerzitě v Moskvě. Po zapojení stejnosměrného proudu do skleněné U-trubice s vodou, v jejímž ohbí byla vrstva práškového křemene, zjistil, že voda není v oba ramenech stejně vysoko, jak by podle zákona o spojených nádobách měla být, ale že u katodie vystoupila mnohem výše než u anody. Tímto pozorováním byl objeven fyzikální jev, který dodnes označujeme jako elektroosmózu.
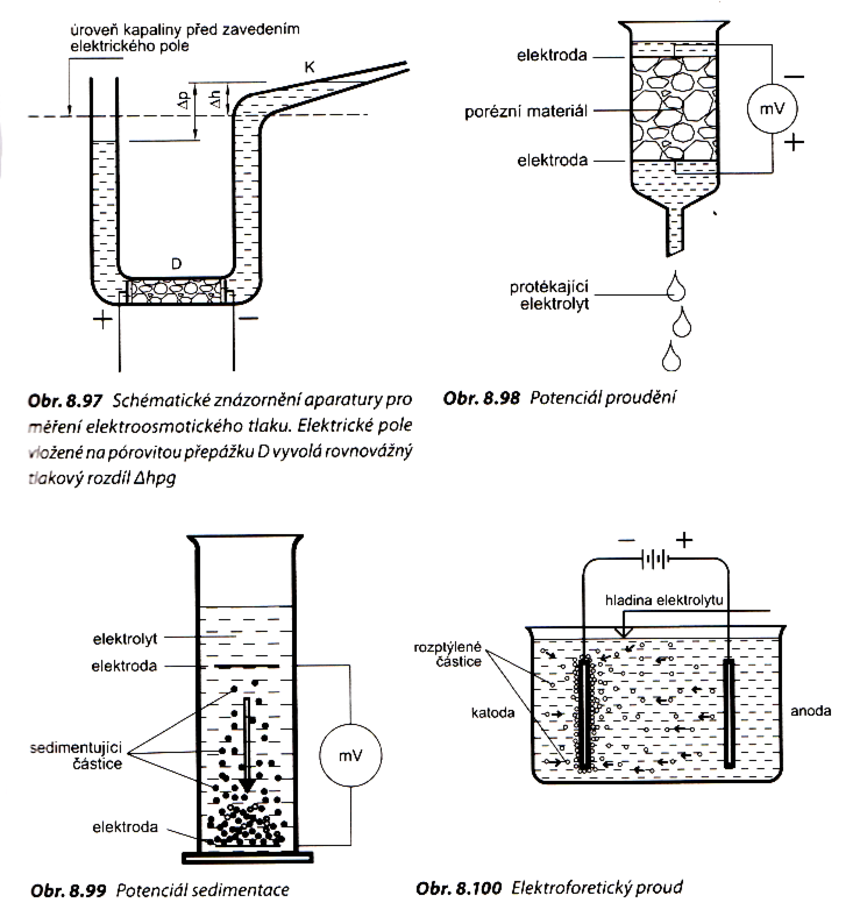
Postupem času byly objeveny a popsány další příbuzné fyzikální jevy, které se navzájem l pohybem pevné a tekuté fáze. Společná fyzikální podstata přisoudila těmto dějům jednotně název elektrokinetické jevy. Jsou to:
- potenciál proudění (obr. 8.98);
- elektroosmóza;
- potenciál sedimentace (obr. 8.99);
- elektroosmotický tlak;
- elektroforéza (obr. 8.100).
Elektroosmóza
Padesát let po pokusu F. F. Reusse byly zjištěny G. Wiedermannem první zákonitosti pohybu vody porézním prostředím vlivem působení stejnosměrného elektrického napětí. Wiedermarnn zjistil, že objem kapaliny převedené působením elektrického pole diafragmatem za tutéž dobu je úměrný velikosti elektrického proudu a nezáleží na tloušťce a průřezu diafragmatu. V roce 1878 se podařilo německému fyzikovi H. Helmholtzovi formulovat matematicky obecné zákonitosti elektroosmózy.
Helmholtz je shrnul do následujících bodů:
- poměr objemu kapaliny převedené elektroosmoticky za jednotku času a proudu je nezávislý na rozměrech materiálu;
- poměr elektroosmotického tlaku a proudu je úměrný poměru délky a průřezu diafragmatu; - prodaný materiál je objem převedené kapaliny i elektroosmotický tlak úměrný zapojenému potenciálnímu rozdílu;
- pro kruhovou válcovou kapiláru je poměr elektroosmotického tlaku a zapojeného potenciálního rozdílu úměrný průřezu kapiláry.
Elektroosmóza je jev zcela obecný a vzniká v soustavách složených z porézní pevné fáze, kde jsou póry vyplněny tekutou fází za vzniku elektrické difuzní dvojvrstvy na rozhraní oba fází. Zpravidla jsou tyto jevy výrazné tam, kde kapalnou fází prostředí je voda, jejíž molekuly jsou výraznými elektrickými dipóly. Molekuly vody jsou částice, v nichž je centrum záporné ho elektrického náboje zřetelně místně odlišné od centra nábojů kladných.
To propůjčuje molekulám vody následující vlastnosti:
- v homogenním elektrickém poli (např. mezi rozlehlými vzájemně rovnoběžnými row nými elektrodami) jsou natáčeny kladným pólem ke katodě a záporným k anodě, ale k žádné z nich nejsou přitahovány;
- v homogenním elektrickém poli (např. v okolí bodového náboje) jsou molekuly vode nejenom natáčeny, ale také puzeny směrem spádu potenciálu pole.
Elektrolýza
Druhý elektrochemický jev, který za určitých podmínek elektroosmózu doprovází na rozhraní tuhá fáze — roztok, se nazývá elektrolýza. Jak již bylo řečeno, hnací silou přenosu vody je spád potenciálu v daném prostředí. Elektrické napětí lze do vzorku vložit prostřednictvím galvanického článku vytvořeného z rozpustné anody a inertní katody nebo vložením stejnosměrného napětí ze samostatného zdroje. Uzavřeným elektrickým obvodem, který tvoří zdroj, kovové přívody, elektrody a elektrolyt ve zdivu, prochází elektrický proud. Tento proud se ve vnějších kovových přívodech a elektrodách (které představují vodiče první třídy) uskutečňuje tokem elektronů. V elektrolytu (jež je vodičem druhé třídy) je tok proudu zprostředkován ionty. lonty nesoucí kladný náboj (kationty) se účinkem elektrického pole mezi elektrodami pohybují k opačně nabité elektrodě, tj. ke katodě, a ionty se záporným nábojem (anionty) se pohybují k anodě.
Přechod elektronu z pevné fáze (např. kovového vodiče) a zpět přes fázové rozhraní je doprovázen chemickými reakcemi spojenými s příjmem a uvolňováním elektronů. Podmínkou těchto elektrochemických reakcí je, aby elektrický potenciál byl větší než termodynamická hodnota napětí kyslíko-vodíkového článku, tj. 1,23 V při 25 *C. Vzhledem k pomalosti elektrochemických reakcí a k různým ztrátám v průběhu přechodu je potřebné dodávané napětí zpravidla podstatně vyšší než je tato termodynamická hodnota.
Jev, při němž dochází k přijetí elektronu iontem na katodě, se nazývá redukcí a jev opačný, probíhající na anodě, se nazývá oxidací. lonty zde uvolňují elektrony a předávají je do vnějšího proudového zdroje, přičemž se příslušné ionty oxidují.
Při elektroosmotickém vysoušení dochází k následujícím elektrodovým reakcím:
- vylučování vodíku z molekul vody na katodě;
- vylučování vodíku z molekul vody na katodě;
- rozpouštění kyslíku na rozhraní voda — vzduch;
- uvolňování vodíku a kyslíku na anodě;
- vylučování chloru.
 |
Zdroj: Odvlhčování staveb Autor: Balík Michael a kolektiv |
Krátké zprávy
-
ForPasiv - veletrh nízkoenergetických, pasivních a nulových staveb › více zde
-
Co se děje s Novou zelenou úsporám a kdy se dozvíme, jak bude pokračovat? › více zde
-
Co se bude řešit v izolacích v příštích letech › více zde
-
Odhady dotací Nová zelená 2026 – co může domácnost očekávat › více zde
-
19.1. - 22.1.INFOTHERMA 2026 Ostrava - vytápění, úspory energií a obnovitelné zdroje › více zde
Pro zákazníky
Rubriky článků
- Zateplení střechy
- Ekologie a energetika
- Zateplování fasády
- Zateplování dřevostaveb
- Názvosloví tepelných izolací
- Izolace a zateplení sklepa
- Pasivní domy
- Stavba - odhlučnění, odvlhčení, reakce na oheň
- Součinitel prostupu tepla
- Tepelné mosty a plísně v domu
- Paropropustnost a difúze
- Třídy reakce na oheň u materiálů
- Objemová hmotnost
- Kondenzace vodní páry
- Tech. postup zateplení fasády
- Návody a typy k zateplení
- Spádování ploché střechy
- Nové hodnoty součinitele prostupu tepla pro budovy(2011)
- Tepelný odpor - výpočty
Rychlé hledání v katalogu
Zobrazit celý katalog
Skelná vata: Dekwool, Isover, Knauf, Ursa, Ursa PureOne
Minerální vata: Baumit, Isover, Knauf Nobasil, Rockwool
Dřevovláknité desky: Pavatex, Steico, Inthermo, Agepan
Dřevocementové desky: Knauf-Heraklith, DCD Ideal, Velox
EPS - expandovaný polystyren: Baumit, Enroll, Isover, Styrotrade
XPS - extrudovaný polystyren: Austrotherm, Dow Chemical, Isover, Synthos, Ursa
PUR - pěnový polyuretan: Eurothane, ITP, Jitrans Trade, PUR Izolace
PIR izolace: Dekpir, Kingspan, Powerline, PUR Izolace, Pama, Satjam
PE - pěnový polyetylén: Ekoflex, Mirel Trading, Fadopex, Fastrade
Pěnové sklo: Foamglas, Ecotechnics, Recifa
Minerální granuláty: Lias
Materiály na bázi kamenné vlny: Machstav, Knauf, Isover
Materiály na bázi papíru a celulózy: Enroll, CIUR, Dektrade
Sendvičové desky a systémy: Kingspan, Marcegaglia, P-Systems, Ruukki
Ovčí vlna: Naturwool, Isolena, Jiří Faltys
Konopí: Insowool, Canabest, Izolace konopí CZ
Ostatní: Džínovina, OSB desky










